Tvåårsuppföljning visar ihållande klinisk effekt av Lumykras vid KRAS G12C-muterad lungcancer
En objektiv tumörrespons på över 40 procent, och en responsduration på över ett år i median samt en progressionsfri medianöverlevnad på mer än ett halvår – det är några av resultaten i tvåårsuppföljningen av studien som låg till grund för godkännandet av Lumykras, den första godkända KRASG12C-hämmaren för behandling av icke-småcellig lungcancer.
– En tvåårsöverlevnad på närmare en tredjedel får anses väldigt bra med tanke på att patienterna är tungt förbehandlade och erhållit såväl immunterapi som platinabaserad kemoterapi, säger docent Jan Nyman, överläkare vid Sahlgrenska universitetssjukhuset i Göteborg och expert på icke-småcellig lungcancer. Att vi dessutom ser en ihållande responsduration inkluderande kompletta remissioner kombinerat med ett förhållandevis milt biverkningsmönster visar på den kliniska nyttan för dessa patienter.
De nya data presenterades vid American Association for Cancer Research (AACR) Annual Meeting 2022 i New Orleans.
I Sverige diagnostiseras årligen omkring 4 200 patienter med lungcancer varav mer än 80 procent har icke-småcellig lungcancer, NSCLC (NSCLC = non-small-cell lung carcinoma). KRAS är den vanligaste kända mutationen inom NSCLC och hela 14 procent av samtliga NSCLC-patienter har den mutation i KRAS-genen som ger upphov till uttryck av proteinet KRASG12C som stimulerar cancercellerna till okontrollerad delning.
På AACR-kongressen i New Orleans presenteras data från en tvåårsuppföljning (median 24,9 månader) av den kliniska fas II-studien CodeBreaK 100 som låg till grund för godkännandet av Lumykras (sotorasib), den första godkända behandlingen som specifikt riktas mot KRASG12C.
I uppföljningen analyserades poolad data från fas I- och fas II-delarna av CodeBreaK 100-studien från 174 patienter med lokalt avancerad eller metastaserad NSCLC som progredierat på platinumbaserad kemoterapi och/eller immuncheckpointhämmare i kombination eller i sekvens. Av patienterna, som behandlades med den godkända dosen av Lumykras på 960 mg dagligen, uppnådde 40,7 procent en komplett (n=5) eller partiell (n=65) respons med en responsduration på 12,3 månader i median, vilket är en längre responsduration jämfört med den tidigare presenterade interimanalysen. Den progressionsfria medianöverlevnaden var 6,3 månader och totalöverlevnaden 12,5 månader i median. Totalöverlevnaden vid ett år var 50,8 procent och 32,5 procent vid två år.
Behandlingen med Lumykras tolererades väl, med generellt mild och hanterbar toxicitet. Hos de patienter som fortsatte med behandlingen efter ett år observerades inga nya säkerhetssignaler.
Resultaten presenterades av Grace K. Dy, MD, chef för thoraxonkologi och professor i onkologi vid Roswell Park Comprehensive Cancer Center, Buffalo, New York, som berättade att man i denna specifika analys också försökt avgöra huruvida det finns potentiella biomarkörer som kan identifiera patienter som kommer att dra långsiktig nytta av behandling med Lumykras. Man kunde konstatera att ihållande tumörsvar var oberoende av PD-L1-status och även kunde observeras i tumörer med lågt uttryck av PD-L1.
Ytterligare analyser av tumör- och blodprover visade att ihållande klinisk nytta var oberoende av tumörmutationsbörda, PD-L1-uttryck och STK11-co-mutation.
– Resultaten talar för att det vore värdefullt att studera huruvida patienter som är mindre mottagliga för immunterapi skulle kunna gynnas av att få Lumykras tidigare i behandlingsförloppet, säger Jan Nyman som är nationellt koordinerande prövare i två sotorasib-studier.
Det gäller dels fas II-studien CodeBreak 201 där sotorasib utvärderas som första linjens behandling hos KRAS G12C-muterade NSCLC-patienter med lågt PD-L1-uttryck och/eller STK11-co-mutation, dels fas-III-studien CodeBreaK 200som jämför sotorasib med docetaxel.
Om KRAS
Närmare 40 år av forskning har visat att RAS-genfamiljen är en av de vanligaste muterade onkogenerna i solida tumörer (RAS = RAt Sarcoma virus). Inom denna familj är KRAS (Kirsten RAt Sarcoma virus) den vanligaste varianten och är särskilt ofta förekommande i solida tumörer. Den beräknade incidensen av den specifika mutationsvarianten KRAS G12C är cirka 13-15 procent vid NSCLC, 3–5 procent vid kolorektalcancer och en till två procent vid många andra solida tumörer. KRASG12C har hittills inte betraktats som ett möjligt mål för läkemedel då proteinet saknar naturliga fickor som en småmolekylhämmare kan binda till.
Om CodeBreaK
Det kliniska studieprogrammet CodeBreaK för sotorasib (AMG 510) är utformat för att behandla flera olika KRAS G12C-muterade solida tumörer i hopp om att möta de ouppfyllda medicinska behov som länge förelegat vid dessa cancerformer.
CodeBreaK 100 är en fas I och II first-in-human, oblindad multicenterstudie som enrollerat patienter med KRAS G12C-muterade solida tumörer. Patienter som bedömdes lämpliga var tungt förbehandlade och hade genomgått minst två tidigare behandlingslinjer.
Det primära effektmåttet i fas I-studien är säkerhet. Viktiga sekundära effektmått inkluderar objektiv tumörrespons (ORR = Objective Response Rate) med utvärdering var sjätte vecka, responsduration (DOR = Duration of Response) och progressionsfri överlevnad. Patienterna delades in i fyra doskohorter, 180 mg, 360 mg, 720 mg och 960 mg. Sotorasib administreras peroralt en gång om dagen i samtliga kohorter.
Det primära effektmåttet i fas II-studien var centralt utvärderad objektiv tumörrespons (ORR = Objective Response Rate). Lumykras, 960 mg, administrerat oralt en gång per dag, resulterade i en objektiv tumörrespons på 37,1 procent (ORR = Objective Response Rate). ORR definierades i detta fall som andel patienter med ≥ 30-procentig minskning av summan av target-lesionens längsta diameter jämfört med baslinjen. Responsdurationen var i median 11,1 månader. Fler än fyra av fem, 80,6 procent, uppnådde sjukdomskontroll (DCR = Disease Control Rate). Progressionsfri medianöverlevnad (PFS = Progression-free Survival) var 6,8 månader och den totala medianöverlevnaden (OS = Overall Survival) var 12,5 månader.
De vanligaste behandlingsrelaterade biverkningarna (TRAE = Treatment-Related Adverse Events) var diarré (32 procent), illamående (19 procent), förhöjt alaninaminotransferas (ALAT) respektive aspartataminotransferas (ASAT) (15 procent vardera). De vanligast förekommande allvarliga (grad ≥ 3) behandlingsrelaterade biverkningarna var förhöjt ALAT (6 procent), förhöjt ASAT (6 procent) och diarré (4 procent). Endast 7 procent avslutade behandlingen till följd av behandlingsrelaterade biverkningar.
Resultatet av den globala randomiserade fas III-studien CodeBreaK 200 som jämför sotorasib med docetaxel väntas bli tillgängliga senare i år.
Mer information om CodeBreaK-programmet finns på www.hcp.codebreaktrials.com.
Om Lumykras (sotorasib)
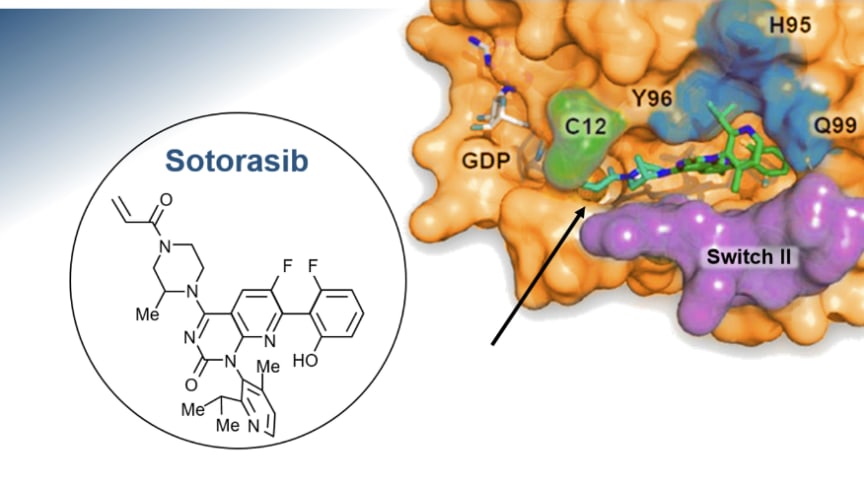
Lumyras (sotorasib) är en first-in-class småmolekylhämmare som specifikt och irreversibelt binder till KRASG12C via den cysteinaminosyra som ersätter glycin när mutationen inträffar. KRASG12C blir på så vis låst i ett inaktivt GDP-bundet tillstånd (GDP = guanosine diphosphate, guanosindifosfat). Detta är möjligt efter att forskarna bakom Lumykras upptäckt en tidigare dold ”räffla” på KRASG12C-proteinet.
För ytterligare information, vänligen kontakta:
Sandra Eketorp Sylvan, medicinsk chef, Amgen, tel: 070–433 57 91